Ornitina entrelazada hialuronato de sodio en polvo
Ornitina entrelazada hialuronato de sodio en polvo |
Pureza: La pureza de los ingredientes de grado cosmético suele ser ≥ 90%, Yel nivel de medicamentos puede alcanzar ≥ 98%. |
Molecular weight: El rango de peso molecular natural es bastante amplio. (por ejemplo, bajo peso molecular: ~10 kDa; alto peso molecular: ~1-5 MDa). |
Apariencia: Polvo generalmente blanco o amarillo pálido, tamaño de partícula Según el proceso de fabricación (como el micrómetro o Nivel nanométrico) |
Paquete: 1g,10g,100g,1000g |

Ornitina entrelazada hialuronato de sodio en polvo
Descripción
Hialuronato de sodio reticulado con ornitina es un derivado de ácido hialurónico (HA) modificado químicamente diseñado a través de reticulación covalente con ornitina, un aminoácido no proteinogénico. Esta modificación mejora el polímero’sEn comparación con la ha lineal, es viscosa, biodegradable y tiene una vida útil in vivo. El producto se suministra en forma de polvo liofilizado estéril para la resolución con un disolvente adecuado.
Deja un mensaje
¡Te llamaremos pronto!
Querida,
Estoy interesado en Ornitina entrelazada hialuronato de sodio en polvo, podría enviarme más detalles como tipo, tamaño, MOQ, material, etc.
¡Gracias!
Esperando su respuesta.
Nombre del producto: Ornitina entrelazada hialuronato de sodio en polvo
Nombre de la materia prima cosmética: Polímero cruzado de hialuronato de sodio
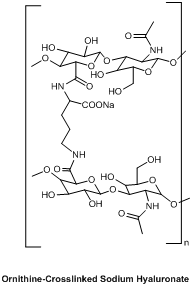
Descripción
El hialuronato de sodio reticulado con Ornitina es un derivado del ácido hialurónico (ha) modificado químicamente que se Ingeniería mediante el enlace cruzado covalente con ornitina, un aminoácido no proteico. Esta modificación mejora el polímero’s En comparación con la ha lineal, es viscosa, biodegradable y tiene una vida útil in vivo. El producto se suministra en forma de polvo liofilizado estéril para la resolución con un disolvente adecuado.
Características principales
Alta elasticidad & Cohesión: se optimiza el soporte organizativo y el volumen.
Biocompatibilidad &Bioabsorbibles: degradación natural por hidrolisis y acción enzimática.
Viscosidad personalizable: las propiedades teológicas se pueden ajustar a través de la densidad de enlace cruzado.
Estéril&Sin fuente de calor: cumple con las normas ISO 13485 y USP para dispositivos médicos.
Uso previsto
Relleno de dermis: para implantes de dermis de profundidad media para corregir arrugas moderadas a graves, pliegues y pérdida de volumen (como fosas nasales y labiales, mejillas).
Lubricación articular: inyección intraarticular para el tratamiento de la osteoartritis (pendiente de aprobación por las autoridades reguladoras).
Cicatrización de heridas: preparaciones locales o inyectables para la regeneración de tejidos.
Composición
| Componentes | Especificaciones |
|--------------------------|---------------------------------------- |
| Hialuronato de sodio |Enlace cruzado con Ornitina [xx%] |
|Residuos de Ornitina | ≤ [x] ppm (análisis por lote) |
| Moisture Content | ≤ 2,0% (método karlfesch) |
| Niveles de LPS | <0,05 EU / mg (prueba lal) |
Guía de reestructuración
1. Disolvente: uso de solución salina tampón de fosfato estéril (pbs) o clorhidrato de Lidocaína (0.3–1.0%) Para aplicaciones clínicas.
2. Proporción: 1: 1 a 1: 2 (polvo: disolvente), dependiendo de la viscosidad requerida (por ejemplo, alta cohesión es de 20 mg / ml).
3. Mezcla: vórtice suave a temperatura ambiente (evite el vórtice) 5–10 minutos hasta la disolución completa.
Almacenamiento & Tratamiento
- Almacenamiento: 2–8°C en el vial sellado original. Evitar la luz y la humedad.
- Fecha de caducidad: 24 meses sin abrir. Usar inmediatamente después de la resolución (estable a ≤24 horas 4: 00°C).
-No congele los productos restaurados.
Seguridad &Precauciones
- Contraindicaciones: alergia al ácido hialurónico, alergia a las proteínas bacterianas Gram - positivas o infección activa en el lugar de la inyección.
Reacciones adversas: eritema temporal, hinchazón o sensibilidad (aliviado en 7 días)–14 días).
Cuidado después del tratamiento: Evite la exposición a los rayos UV, el calor excesivo o la actividad extenuante durante 48 horas.
Estado regulatorio
- El marcado CE es un dispositivo médico de clase III (ue).
- Para uso de investigación en Estados Unidos (no aprobado por la administración de alimentos y medicamentos de Estados unidos).
Embalaje
-Forma: polvo liofilizado en botellas de vidrio estériles.
- Especificaciones: 10 mg, 20 mg, 50 mg por botella.
Este producto es solo para profesionales de la salud con licencia. Cumplir siempre con las regulaciones locales y las pautas clínicas *.
¡Si necesita ajustar los requisitos regulatorios específicos o los detalles de la aplicación, ¡ por favor, dime!
Recommended Products








